MPBSE 12th Chemistry imp question 2022 pdf download | एमपी बोर्ड कक्षा 12 रसायन विज्ञान महत्वपूर्ण प्रश्न 2022 pdf
पाठ 2 विलयन ( SOLUTION )

1. 180 ग्राम जल में जल के कितने मोल होते हैं?
(अ) 1 मोल (ब) 18 मोल
(स) 10 मोल (द) 100 मोल
2. 5 मिलीग्राम छंब्स प्रति लीटर होता है-
(अ) 5 पी.पी.एम. (ब) 50 माइक्रोग्राम मिली-1
(स) 0.25 माइक्रोग्राम मिली-1 (द) 0.066 मोल मिली-1
3. औसत या शुद्ध जल की मोलरता है-
(अ) 100 M (ब) 55.5 M
(स) 18 M (द) 50 M
4. 1 मोलल विलयन में विलेय का मोल प्रभाज होता है-
(अ) 1 (ब) 1.8
(स) 18 (द) 0.018
5. नि.लि. में से कौन-सा विलयन का अणुसंख्यक गुणधर्म नहीं है?
अथवा
नि.लि. में से विलयन का कौन-सा गुण अणुओं की संख्या पर निर्भर नहीं करता है-
(अ) पृष्ठ तनाव (ब) परासरण दाब
(स) वाष्पदाब में अवनमन (द) हिमांक में अवनमन
6. नि.लि. में से सबसे कम वाष्पदाब वाला विलयन है-
(अ) 1 M ग्लूकोज (ब) 1 M सुक्रोस
(स) 1 M NaCl (द) 1 M K2SO4
7. सर्वाधिक क्वथनांक प्रदर्शित करने वाला जलीय विलयन है-
(अ) 0.015 M ग्लूकोज (ब) 0.01 M KNO3
(स) 0.15 M यूरिया (द) 0.01 M Na2SO4
8. हिमांक का अवनमन सीधा समानुपात दर्शाता है-
(अ) विलयन का मोल अंश (ब) विलयन की मोलरता
(स) विलयन की मोललता (द) विलायक की मोललता
अति लघुउत्तरीय प्रश्न
MPBSE 12th Chemistry imp question 2022- ( MPBSE 12TH रसायन विज्ञान 1-1 नंबर के सभी महत्वपूर्ण प्रश्न नीचे दिए गए है- )
प्रश्न 1. जलीय जीव, गर्म, जल की तुलना में ठण्डे जल में अधिक सहज क्यों महसूस करते हैं?
उत्तर – वायुमण्डल पर ताप कम करने से जल में ऑक्सीजन की विलेयता बढ़ जाती है जबकि समान दाब पर ताप बढ़ने पर ऑक्सीजन की विलेयता कम हो जाती है। अतः कम ताप पर अधिक ऑक्सीजन की उपस्थिति जलीय जीवों को ठण्डे जल में अधिक सहज बनाती है।
प्रश्न 2. मोलल अवनमन स्थिरांक Kf क्या होता है?
उत्तर- किसी विलायक के 1000 ग्रामों में किसी विद्युत अपघट्य के एक ग्राम मोल को घोलने पर उसके हिमांक में जो अवनमन होता है, वह उस विलायक का मोलल अवनमन स्थिरांक कहलाता है।
अतः किसी विलायक का मोलल अवनमन स्थिरांक
Kf = (M × ΔTf × w)/1000×W
जहाँ, M = विलेय का अणुभार
w = विलायक का भार
W = विलेय का भार
ΔTf = हिमाँक में अवनमन
प्रश्न 3 – अर्द्धपारगम्य झिल्ली क्या होता है?
उत्तर- अर्द्धपारगम्य झिल्ली एक प्राकृतिक अथवा कृत्रिम सतत् शीट या परत होती है, जिसमें अतिसूक्ष्म दर्शीय छिद्रों का जाल होता है और इन अतिसूक्ष्म दर्शीय छिद्रों से जल कैसे विलायक के छोटे अणु तो गुजर सकते हैं परन्तु विलेय के बडे़ अणुओं के गुजरने में बाधा उत्पन्न होती है।
उदाहरण – चर्मपत्र, अण्डे की झिल्ली, काॅपर, फेरोसानाइड झिल्ली आदि अध्र्दपारगम्य झिल्लियाँ हैं।
प्रश्न 4 – मोलरता तथा मोललता की परिभाषा दीजिए तथा इनमें अन्तर स्पष्ट कीजए।
उत्तर- मोललता 1000 ग्राम विलायक में घुले विलेय के ग्राम अणुओं (मोलो) की संख्या को उस विलयन की मोललता कहते हैं।
मोलरता किसी विलयन की 1000 मिली या 1 लीटर में घुले विलेय के ग्राम अणुओं (मोलों) की संख्या को विलयन की मोलरता कहते हैं।
अन्तर- मोललता ताप के साथ परिवर्तित नहीं होती जबकि मोलरता ताप के साथ परिवर्तित होती है।
प्रश्न 5 – मोल अंश से आप क्या समझते हैं? उदाहरण सहित समझाइए।
उत्तर – मोल अंश विलयन मे उपस्थ्थित किसी एक घटक या अवयव के मोलों की संख्या तथा विलेय एवं विलायक के कुल मोलों की संख्या के अनुपात को उस अवयव का मोल – अंश कहते हैं।
इसे से व्यक्त करते हैं।
प्रश्न 6 – मोलल उन्नयन स्थिरांक से आप क्या समझते हैं? यह विलयन की मोललता से किस प्रकार सम्बंधित है। अथवा
मोलल उन्नयन स्थिरांक को परिभाषित कीजिए। इसका मात्रक भी दीजिए।
उत्तर – किसी विलायक के 1000 ग्राम में किसी अवाष्प्शील विद्युत अपघट्य का एक ग्राम अणु घोलने उन्नयन स्थिरांक कहलाता है।
इसे Kb या K1000 से व्यक्त करते हैं।
इसका मात्रक केल्विन-किग्रा मोल-1 है।
ΔTb = Kb × मोललता (m)
जहाँ, ΔTb= क्वथनांक में उन्नयन
प्रश्न 4. परासरण दाब को उदाहरण द्वारा समझाइए।
उत्तर – यह कम से कम बाहरी दाब जो विलयन पर लगााने से उसका वाष्पदाब उसके विलायक के वाष्पदाब के बराबर कर देता है या किसी विलयनके ऊपर लगने वाला वह कम से कम बाह्य दाब जो इस विलयन व उसके विलायक के मध्य परासरण की रोक देता है, परासरण दाब कहलाता है।
कक्षा 12 भौतिक विज्ञान के सभी महत्वपूर्ण प्रश्नों 2022 के लिए यहाँ पर क्लिक करें।
प्रश्न 5. प्रतिलोम परासरण से आप क्या समझते हैं? उदाहरण सहित समझाइए।
उत्तर – अर्द्धपारगम्य झिल्ली द्वारा पृथक किए गए दो भिन्न सान्द्रता वाले विलयनों (या विलयन एवं शुद्ध विलायक) में से अधिक सान्द्र विलयन (या विलयन) पर उसके परासरण दाब से अधिक दाब आरोपित करने पर विलायक, विलयन (अधिक सान्द्र) से कम सान्द्र विलयन (या शुद्ध विलायक) की ओर प्रवाहित होने लगता है इस घटना को प्रतिलोम परासरण कहते हैं।
उदाहरण – समुद्री जल से या कठारे जल से शुद्ध जल को प्राप्त करने में इसी प्रक्रम का प्रयोग किया जाता है।
प्रश्न 9. राउल्ट के वाष्पदाब अवनमन नियम को परिभाषित कीजिए तथा उसकी सीमाएँ बताइए।
उत्तर – राउल्ट के नियम : राउल्ट के नियम के अनुसार किसी विलायक में अवाष्प्शील विलेय मिलाने पर प्राप्त विलयन के वाष्प् दाब का आपेक्षिक अवनमन उसमें विद्यमान विलेय पदार्थ के मोल प्रभाज के बराबर होता है।
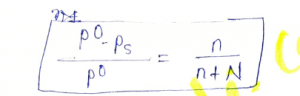
जहाँ, P0 तथा Ps क्रमशः विलायक तथा विलयन के वाष्पदाब है और n तथा N क्रमशः विलेय तथा विलायक के ग्राम अणुओं की संख्या है। यदि विलयन अति तनु होता है तो n का मान N की अपेक्षा बहुत कम होता है।
n + N ≈ N
अतः इस दशा में ( P0 – Ps ) / P0 = n / ( n + N )
समीकरण प्रयुक्त करते हैं जो अवाष्प्शील विलेय के तनु विलयनों पर लागु होती है।
राउल्ट के नियम की सीमाएँ –
1. राउल्ट के नियम तनु विलयनों पर लागु होता है। सान्द्र विलयन राउल्ट के नियम से विचलन प्रदर्शित करते हैं।
2. यह नियम केवल अवाष्प्शील पदार्थाें के विलयनों पर लागु होता है।
3. विद्युत अपघट्य के विलयनों पर राउल्ट का नियम लागु नहीं होता है।
4. जो पदार्थ विलयन में संगुणित या वियोजित हो जाते हैं उन पदार्थों के विलयन भी राउल्ट के नियम का पालन नहीं करते हैं।
MPBSE 12th Chemistry imp question 2022 यह प्रश्न के उत्तर आपको जरूर याद करने है क्यूकी ये सभी प्रश्न लगातार बोर्ड परीक्षा में आते रहते है।
प्रश्न 10. 5.85 गाम सोडियम क्लोराइड 200 मिली विलयन में घुला है। विलयन की मोलरता की गणना कीजिए।
हल – विलयन मे NaCl के मोलों की संख्या
= द्रव्यमान/आण्विक द्रव्यमान
= 5.85 ग्राम/58.5 ग्राम मोल-1
= 0.1 मोल
विलयन का आयतन = 200 मिली = 0.2 लीटर
∴ NaCl विलयन की मोलरता
= विलयन में NaCl के मोलों की संख्या / विलयन का आयतन (लीटर में)
= 0.1/0.2
= 0.5 मोल
प्रश्न 11. 3 ग्राम यूरिया को 100 ग्राम जल में घोलने र जल के क्वथनांक में उन्नयन की गणना कीजिए।
जल के लिए मोलल उन्नयन स्थिरांक का मान 0.252 केल्विन किग्रा मोल-1 है।
हल – क्वथ्थनांक में उन्नयन विधि से
ΔTb = (1000 × Kb ×w) / m × W
जहाँ, Kb = जल का मोलल उन्नयन स्थिरांक = 0.52 केल्विन किग्रा मोल-1
w = विलेय (यूरिया) की प्रयुक्त मात्रा = 3 ग्राम
W = विलायक (जल की मात्रा) = 1000 ग्राम
m = यूरिया (NH2CONH2) का अणुभार = 60
इसलिए मान रखने पर,
ΔTb = (1000×0.52×3) / 60×100
= 0.26K
कक्षा 12 सभी विषयों के नोट्स पाने के लिए नीचे दिए हुए लिंक्स् पर क्लिक करें–
- mpbse 12th class physics notes 2022 pdf download
- mpbse 12th class chemistry notes 2022 pdf download
- mpbse 12th class math notes 2022 pdf download
- mpbse 12th class biology notes 2022 pdf download
- mpbse 12th class hindi notes 2022 pdf download
- mpbse 12th class english notes 2022 pdf download
प्रश्न 12. 2.25 ग्राम ग्लूकोस (अणुभार = 180) को 25 ग्राम जल में घोलने पर हिमांक में 930C की कमी होती है। जल के मोलल अवनमन स्थिरांक की गणना कीजिए।
हल – हिमाँक में अवनमन विधि से किसी विलायक का मोलल अवनमन स्थिराँक
Kf = ( m × ΔTb × w ) / ( 1000×W )
जहाँ, M = विलेय (ग्लूकोस) का आण्विक द्रव्यमान = 180
w = विलेय (ग्लूकोस) का द्रव्यमान = 2.25 ग्राम
W = विलायक (जल) का द्रव्यमान = 25 ग्राम
ΔTb = हिमांक में अवनमन = 930C = 0.93 K
Kf = (180×0.93×25)/1000×2.25
= 1.86 केल्विन किग्रा मोल-1
MPBSE 12th Chemistry imp question 2022 ( pdf download ) क्या इन प्रश्नों को पढ़कर पास हो सकते है-
जी हाँ, प्यारे छात्रों आप बिल्कुल इन सभी प्रश्नों को पढ़क आसानी से पास हो सकते है क्यूकी ये सभी प्रश्न बोर्ड परीक्षा में विगत वर्षों से लगातार आ रहे है, तो इन सभी प्रश्नों के आगे आने वाले सभी बोर्ड परीक्षाओं में भी आने की उम्मीद बहुत ज्यादा हो जाती है, इसलिए आप सभी से आग्रह रहेगा की एक बार इन सभी प्रश्नों का रिवीजन करके आपको जरूर जाना है।
प्रश्न 13. 00C ताप पर 0.45 ग्राम ग्लूकोस का 250 मिली जल में घोलकर विलयन बनाया गया। इसका परासरण दाब क्या है?, ( R = 0.0821 ली. वायुमण्डल डिग्री-1 मोल-1 )
हल – विलयन का परासरण दाब (π) = CST
जहाँ C = विलयन का मोलर सान्द्रण
S = विलयन स्थिरांक = R = 0.0821 ली. वायुमण्डल डिग्री-1मोल-1
T = केल्विनमें तापक्रम = 0ºc + 273 = 273K
ग्लूकोस विलयन की सान्द्रता = 0.45 ग्राम 250-1 मिली
= (0.45 × 4 )ग्राम ली.-1
= 1.80 ग्राम ली.-1
ग्लूकोस विलयन की सान्द्रता (C) = सान्द्रता (ग्राम ली.-1में) / मोलर द्रव्यमान
= 1.80 ग्राम ली.-1 / 180ग्राम मोल-1
= 0.01m
चूँकि ग्लूकोस का अणुभार = 6×12 + 1×12़ + 6×16
= 180 ग्राम मोल-1
मान रखने पर,
π = ( 0.01× 0.0821× 273 ) वायुमण्डल
= 0.224 वायुमण्डल
[WPSM_AC id=842]
कक्षा 12 रसायन विज्ञान के सम्पूर्ण पाठों के महत्वपूर्ण प्रश्न 2022 बोर्ड परीक्षा के लिए
| पाठ संख्या | पाठ का नाम | डाउनलोड लिंक |
| 01. | ठोस अवस्था | Click Here |
| 02. | विलियन | Click Here |
| 03. | विधयुत रसायन | Click Here |
| 04. | रासायनिक बलगतिकी | Click Here |
| 05. | प्रष्ट रसायन | Click Here |
| 06. | तत्वों के निष्कर्षण के सिद्धान्त एवं प्रक्रम | Click Here |
| 07. | p- ब्लाक के तत्व | Click Here |
| 08. | d और f – ब्लाक के तत्व | Click Here |
| 09. | उपसहसंयोजन यौगिक | Click Here |
| 10. | हैलोएल्केन्स और हैलोएरीन्स | Click Here |
| 11. | ऐल्कोहाल, फिनाल और ईथर | Click Here |
| 12. | एल्डिहाइड, कीटोन, कार्बोक्सिलिक अम्ल | Click Here |
| 13. | नाइट्रोजन युक्त कार्बनिक यौगिक | Click Here |
| 14. | जैव अणु | Click Here |
| 15. | बहुलक | Click Here |
| 16. | रोजमर्रा की जिंदगी में रसायन शास्त्र | Click Here |
कक्षा 12 सभी विषयों के महत्वपूर्ण प्रश्नों के नीचे दिए हुए लिंक पर क्लिक करें–
- mpbse 12th class PHYSICS imp question 2022 pdf download
- mpbse 12th class CHEMISTRY imp question 2022 pdf download
- mpbse 12th class BIOLOGY imp question 2022 pdf download
- mpbse 12th class MATH imp question 2022 pdf download
- mpbse 12th class HINDI imp question 2022 pdf download
- mpbse 12th class ENGLISH imp question 2022 pdf download
आज के इस पोस्ट में आपने MPBSE 12th Chemistry imp question 2022 pdf download को पढ़ा। अगर आपको ये वाला पोस्ट अच्छा लगा हो तो इस पोस्ट को शेयर जरूर करना जिससे अधिक से अधिक छात्रों की मदद हो सके क्यू की ये सभी प्रश्न बोर्ड परीक्षा 2022 के लिए बहुत महत्वपूर्ण साबित होंगे।
MPBSE 12th Chemistry imp question 2022 pdf download
MPBSE 12th Chemistry imp question 2022 pdf download
MPBSE 12th Chemistry imp question 2022 pdf download